
本次推文内容速览:
在之前的文章“蛋白翻译后修饰——磷酸化(一)”、“蛋白翻译后修饰——磷酸化(二)”中,伯小远为大家介绍过磷酸化的一些基础知识以及部分研究方法,不了解磷酸化的同学通过这两篇文章可以对磷酸化有一个大概的认识。
在众多的蛋白翻译后修饰(PTM)类型中,磷酸化修饰(Phosphorylation modification)的蛋白占到了所有蛋白质约三分之一的比例,是最普遍的修饰类型之一。蛋白质的磷酸化和去磷酸化作为一种“分子开关”(Olsen et al., 2006),通过影响蛋白质的结构、定位和功能,在细胞的信号转导、转录翻译、代谢和发育等生命过程中发挥着重要作用。总而言之,磷酸化作为生命活动最基础的修饰,蛋白的磷酸化研究一直受到研究者的广泛关注。因此,伯小远想为大家总结一下磷酸化在植物学研究中都发挥了哪些作用。
磷酸化在非生物胁迫中的作用
非生物胁迫,如干旱、盐度或温度变化,损害了主要作物的生产力,是全球作物减产的主要原因,使全球作物的平均产量下降了50%以上(Boyer J S, 1982;Wang et al., 2003)。这些环境胁迫通过影响各种细胞和整个生命过程来影响植物的产量和质量(Wang et al., 2000;Wang et al., 2003)。
为了对抗环境胁迫的不利影响,植物进化出了适应机制或特定的生长习惯来避免胁迫(Dorothea Bartels and Ramanjulu Sunkar, 2005)。它们的反应是动态的,包括可逆和不可逆的变化、膜系统的调整、细胞壁结构的改变,以及细胞分裂的变化(Grant R. Cramer, 2010;Aleksandra Skirycz and Dirk Inze, 2010;Cramer et al., 2011)。此外,相容溶质(如脯氨酸或棉子糖)的产生有助于稳定蛋白质和细胞结构或维持细胞膨压,并降低过量的ROS水平(Dorothea Bartels and Ramanjulu Sunkar, 2005;Babu Valliyodan and Henry T Nguyen, 2006;Laszlo Szabados and Arnould Savoure, 2010;Julia Krasensky and Claudia Jonak, 2012)。非生物应激反应也受表观遗传(Khraiwesh et al., 2012;Yuan et al., 2013)和转录调控的影响,这些调控会改变大量基因的表达,包括参与渗透保护剂、解毒酶、转运蛋白和调节蛋白(如蛋白激酶、磷酸酶和转录因子)合成的基因(Julia Krasensky and Claudia Jonak, 2012;Chinnusamy et al., 2007;Kazuo Shinozaki and Kazuko Yamaguchi-Shinozaki, 2007)。
植物应对非生物胁迫的响应可以见图1,从图中可以看出磷酸化可以参与一些微调,从而来应对非生物胁迫。

图1 植物非生物胁迫响应及基因工程策略干预要点(Cabello et al., 2014)。环境胁迫条件,如干旱、盐度、极端温度和高辐照会诱导植物激活复杂的调控网络,使植物建立防御反应。传感器系统触发下游信号传导和转录调控级联,这一过程涉及许多转录因子家族(TF),最终导致细胞基因表达程序的广泛变化。在这种情况下,激素反应将植物的发育、生理与环境线索相结合。活性氧(ROS)在调节网络中作为强大的信号分子进行运作。应激诱导的基因编码调节成分和效应蛋白,激活应激反应机制,以重建细胞内稳态,消除有毒化合物,保护和修复受损的蛋白质和细胞膜。反应的微调是由蛋白质翻译后修饰支持的,例如泛素化、类泛素化和磷酸化,以及基因表达的表观遗传调控。应激诱导的小RNA(miRNAs和siRNAs)的转录后调控构成了可用于基因工程方法的另一种调控层。
磷酸化与冷胁迫
蛋白激酶介导的磷酸化已被发现可调节植物的冷胁迫。在植物细胞中,质膜流动性的变化可能是冷胁迫的主要传感器;然而,精确的机制以及细胞如何传导和微调冷信号仍然不太清楚。
在“Plasma Membrane CRPK1-Mediated Phosphorylation of 14-3-3 Proteins Induces Their Nuclear Import to Fine-Tune CBF Signaling during Cold Response”一文中,作者发现冷激活质膜蛋白冷响应蛋白激酶1(CRPK1)磷酸化14-3-3蛋白。磷酸化的14-3-3蛋白从细胞质穿梭到细胞核,在那里它们与关键的冷反应C-重复结合因子(CBF)蛋白相互作用并破坏其稳定性。与此相一致的是,crpk1和14-3-3kλ突变体的抗冻性增强,而过表达14-3-3λ的转基因植株的抗冻性降低。进一步的研究表明,CRPK1在14-3-3蛋白的核易位和抗冻功能中起着至关重要的作用。因此,作者的研究表明,CRPK1-14-3-3模块将冷信号从质膜传导到细胞核,调节CBF的稳定性,从而确保植物对冷胁迫的调节反应。
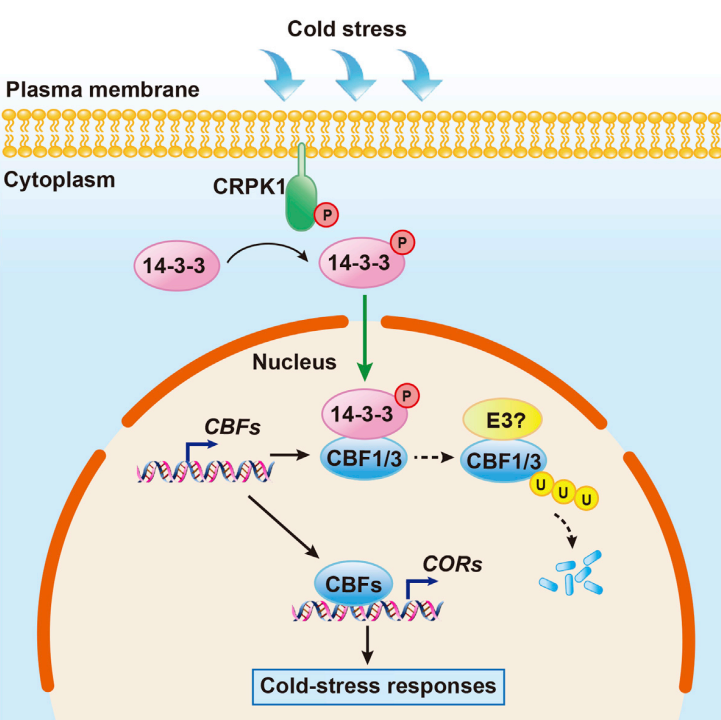
图2 CRPK1和14-3-3蛋白调控CBF信号通路的模型(Liu et al., 2017)。未知的RLK可能参与冷信号感知,并在冷胁迫下磷酸化CRPK1。冷激活的CRPK1磷酸化14-3-3蛋白,这些蛋白从细胞质转运到细胞核,促进蛋白酶体介导的CBF1和CBF3的降解,从而负向调节COR的表达和抗冻性。
磷酸化与盐胁迫
土壤盐分高是一个严重的环境胁迫,限制了植物的生产力,了解盐胁迫下的细胞信号通路是很重要的。拟南芥中,SOS(Salt oversensitive)通路是盐胁迫耐受所需的主要信号通路。SOS通路由SOS1、SOS2和SOS3三种蛋白组成。SOS2是盐胁迫下的关键激酶之一。在拟南芥的盐胁迫信号传导和耐受性中至关重要。已知SOS2可被钙-SOS3和其激活环(激活环是多种激酶中高度保守的区域,许多蛋白激酶是通过其激活环内一个或多个残基的磷酸化而激活的)上的磷酸化所激活。SOS2在体外是自磷酸化的,但其自磷酸化位点及其在耐盐性中的作用尚不清楚。
在“An Autophosphorylation Site of the Protein Kinase SOS2 Is Important for Salt Tolerance in Arabidopsis”中,作者鉴定了SOS2中的一个自磷酸化位点,并分析了其在拟南芥对盐胁迫响应中的作用。质谱分析显示SOS2的Ser 228是自磷酸化的。当该位点突变为Ala时,SOS2的自磷酸化速率降低。突变SOS2对底物的磷酸化程度也低于野生型SOS2。相反,将Ser 228转变为Asp来模拟自磷酸化,可以增强SOS2对底物的磷酸化。对sos2突变体的互补试验表明,S228A而非S228D突变部分破坏了SOS2的耐盐功能。作者还发现,Thr168位点的激活环磷酸化和Ser 228位点的自磷酸化不能相互替代,这表明两者都是耐盐所必需的。作者的研究结果表明,SOS2的Ser 228被自磷酸化,并且这种自磷酸化对盐胁迫下SOS2的功能很重要。
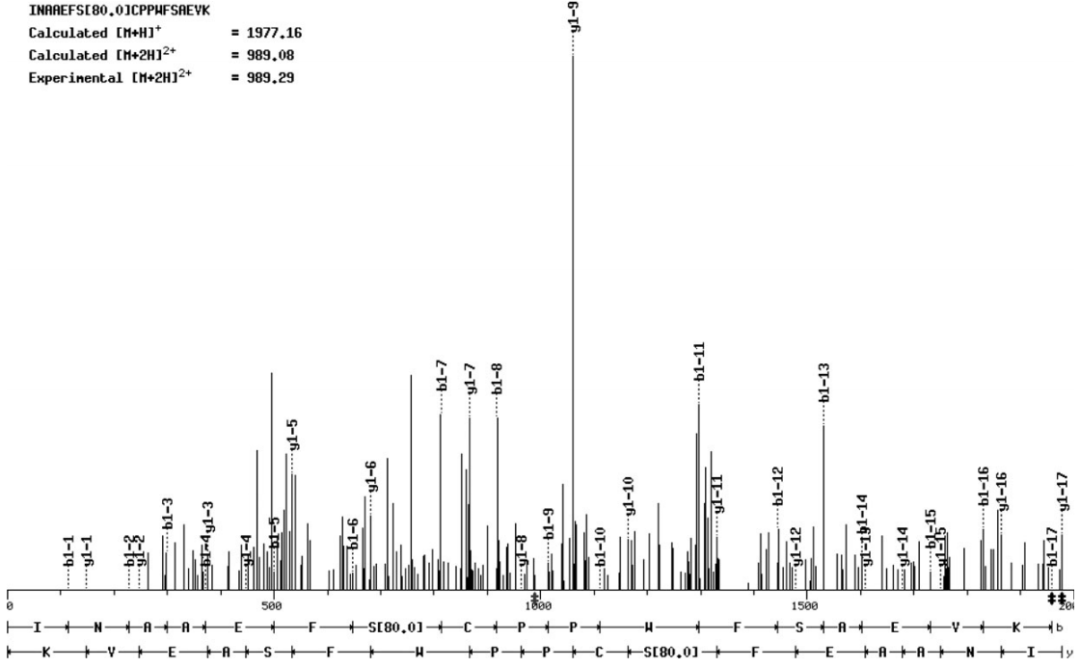
图3 在MS/MS肽序列数据中,Ser 228上存在一个磷酸基。N端和C端肽片段离子分别用b离子和y离子系列表示(Hiroaki Fujii and Jian-Kang Zhu, 2009)。
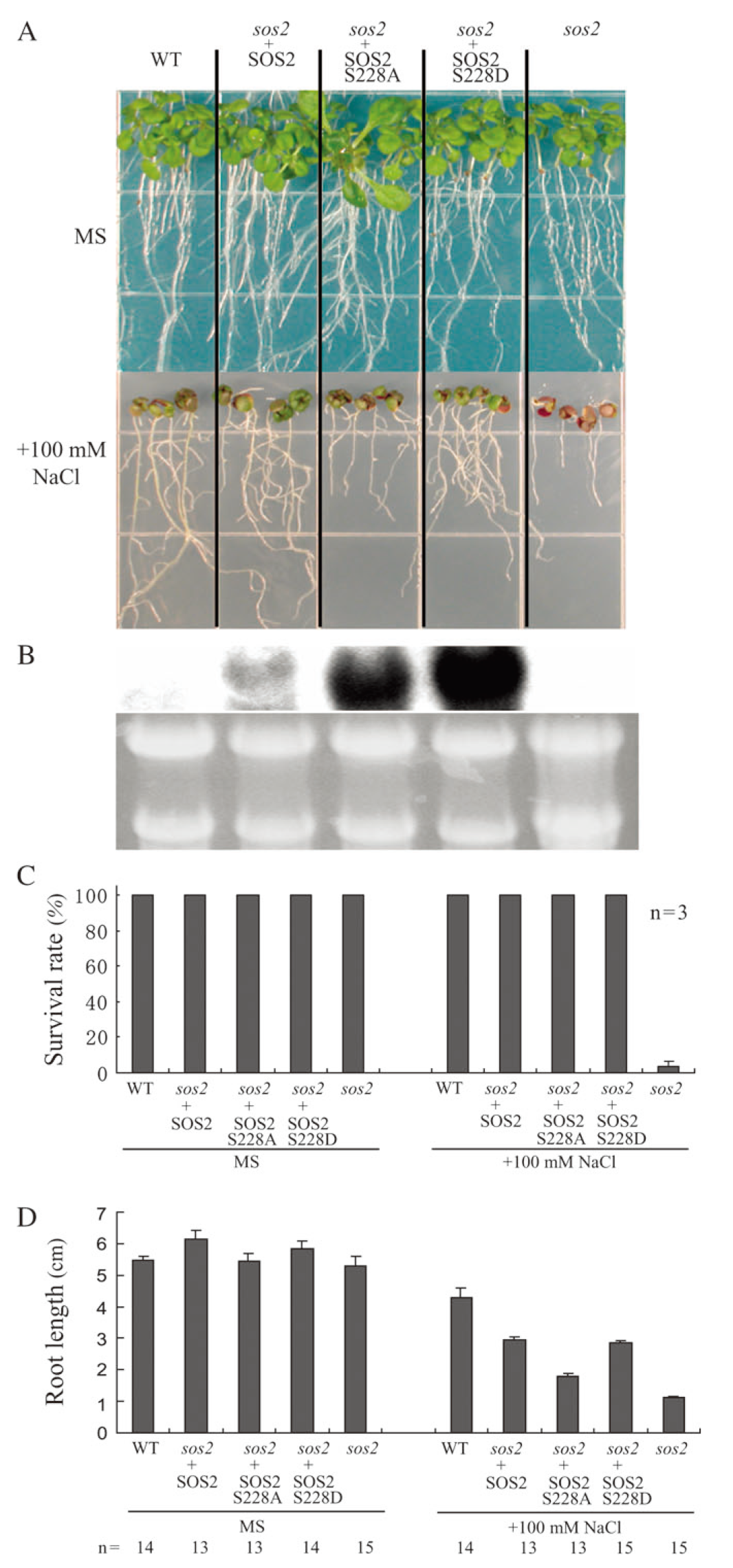
图4 表达SOS2 S228A或S228D的sos2-2植株耐盐性试验(Hiroaki Fujii and Jian-Kang Zhu, 2009)。(A)将在MS板上生长的野生型(WT)、以及在sos2-2中表达的SOS2-2、SOS2 S228A或SOS2 S228D的植株以及sos2-2转基因植株的3日龄幼苗分别转移到添加或不添加100mM NaCl的MS板上。(B)转移至100mM NaCl的MS板上12h后提取RNA,用RNA凝胶印迹分析显示SOS2的转录水平。(C)添加100mM NaCl或不加NaCl的MS板上幼苗的存活率。(D)在添加或不添加100mM NaCl的条件下,将幼苗转移到MS板上12d后的主根长度。
磷酸化在生物胁迫中的作用
那些由细菌、真菌、昆虫、杂草引起的对植物生存与发育不利的情况,被称之为“生物胁迫”。生物胁迫不仅影响农作物、园艺植物的品质,同时也会使农作物的产量严重减产。因此,开展对生物胁迫的基础研究显得尤为重要,但是相比于非生物胁迫的研究,目前科学家们对生物胁迫的研究似乎没有特别多,小远这里就主要以免疫相关的生物胁迫文献为大家简单讲讲磷酸化在其中发挥的作用!
磷酸化与共生及免疫
植物会遇到无数的微生物,特别是在根-土壤界面,它们的入侵可能会带来有益的结果,但也有可能带来有害的结果。植物和微生物之间比较常见的有益联系包括那些通过促进获得氮和磷等限制性营养物质来促进植物生长的联系。但是,在促进这种共生关系的同时,植物必须限制致病关系的形成。要实现这种平衡,就需要通过它们产生的信号来感知潜在的入侵微生物,然后激活促进微生物定植的共生反应或限制它的免疫反应。下面摘取“Plant signalling in symbiosis and immunity”一文中的部分内容,大家简单了解一下,想要了解更具体的内容,大家可以自行查看这篇文献噢!
植物对微生物信号的识别,无论是病原体相关分子模式(PAMPs)还是共生信号,都涉及到细胞表面受体激酶复合物。PAMP识别的受体可以是受体激酶,即参与配体感知的胞外结构域、单通道跨膜结构域和胞内激酶结构域,也可以是具有胞外结构域但缺乏胞内信号结构域的受体样蛋白(Daniel Couto and Cyril Zipfel, 2016)。图5显示了参与微生物信号感知的主要受体复合物的类别。
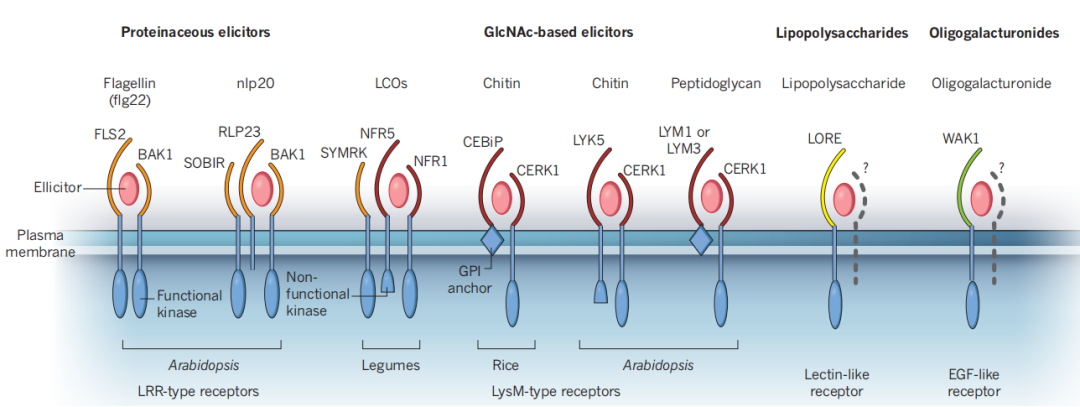
图5 参与微生物感知的LysM-受体-激酶复合物(Cyril Zipfel and Giles E. D. Oldroyd, 2017)。显示了参与微生物信号感知的主要受体复合物的类别。一般来说,蛋白质诱导(例如,鞭毛蛋白flg22和nlp20,一个在细菌、真菌和卵菌中保守的表位)被具有LRR型胞外结构域(橙色)的受体感知,该受体也与LRR型共受体相关。基于GlcNAc的诱导子,如LCOs、几丁质和肽聚糖被存在于受体复合物中的LysM基序(红色)结合。与脂多糖识别相关的受体(类受体凝集素,黄色)和低聚半乳糖醛酸(EGF型受体,绿色)相关的受体也正在被发现。每个受体复合物包含至少一个具有功能性或非功能性激酶基序的受体样激酶。这些复合物还可以包括含有跨膜结构域和胞外结构域但缺乏胞内信号域的受体样蛋白(例如nlp20受体中的RLP23),或通过糖基磷脂酰肌醇(GPI)锚定在膜上的细胞外蛋白(例如水稻几丁质受体中的CEBiP和拟南芥肽聚糖受体中的LYM1和LYM3)。EGF,表皮生长因子。
受体复合物的下游信号传递涉及多种过程,在免疫和共生信号通路之间有明显的相似之处。植物细胞对PAMPs的识别导致了一系列的细胞事件,包括外质体活性氧的产生,胞质钙浓度的增加,胞质丝裂原活化蛋白(MAP)激酶和钙依赖蛋白激酶(CDPKs)级联的激活,以及转录变化(Müller et al., 2016)。图6展示了植物免疫和共生细胞内信号通路,可以发现通路中是存在磷酸化作用的。

图6 植物免疫和共生细胞内信号通路(Cyril Zipfel and Giles E. D. Oldroyd, 2017)。植物免疫信号传导(左)和共生信号传导(右)的简化模型,图中显示了这些信号传导途径的主要成分。对于免疫信号传递,图中显示了鞭毛蛋白表位flg22的感知途径。FLS2-BAK1受体复合物对flg22的识别导致受体样细胞质激酶BIK1的磷酸化,然后磷酸化NADPH氧化酶RBOHD的N端,从而导致活性氧的产生。这种释放被认为是激活位于质膜上的一个未知的钙通道,导致钙流入细胞质,并被CDPKs识别,进一步磷酸化RBOHD并增强其激活。CDPKs还可能磷酸化其它被认为参与植物免疫相关基因激活的靶点。与钙介导的途径平行,一个MAP激酶(MAPK)途径导致控制免疫基因表达的各个方面的WRKY转录因子的磷酸化。共生信号涉及通过LysM受体激酶NFR1和NFR5和含LRR的受体复合激酶SYMRK(在苜蓿中称为DMI2)的受体复合体识别Nod-LCOs。通路激活导致活性氧的爆发和钙通过质膜的流入,类似于在免疫信号传递中观察到的情况。NADPH氧化酶RBOH和质膜定位钙通道参与共生信号传导尚未明确。LCOs和几丁质寡糖的识别也会激活了细胞核中的钙振荡。与SYMRK相关的3-羟基-3-甲基戊二酰辅酶A还原酶(HMGR)参与了甲羟戊酸的产生,甲羟戊酸可能是细胞核的二级信使。位于核膜上的几个通道协调钙从核膜和内质网的释放:DMI1复合物(在Lotus中称为POLLUX)和CNGC15调节钾和钙的逆流,使这些离子流动而不影响膜极性,钙ATP酶MCA8将钙泵回核膜。核钙振荡激活CCAMK,被激活的CCAMK磷酸化CYCLOPS促进共生基因表达的诱导。
磷酸化与免疫
植物作为一种固着生物,面对来自病原体的无尽攻击,有效的植物免疫依赖于及时感知和传播与病原体感染相关的信号。植物通过细胞表面模式识别受体(PRRs)来感知非自身分子,从而启动免疫。PRRs主要是丝氨酸/苏氨酸(Ser/Thr)受体激酶,与动物白细胞介素-1受体相关激酶(IRAK)/颗粒可溶性激酶进化相关。然而,如何调节这些受体激酶的活性仍然知之甚少。
在“A Tyrosine Phosphorylation Cycle Regulates Fungal Activation of a Plant Receptor Ser/Thr Kinase”一文中作者报道了拟南芥PRR几丁质诱导子受体激酶1(CERK1)在未受刺激的细胞中酪氨酸428(Tyr428)位点自磷酸化,这是CERK1与真菌细胞壁成分几丁质结合时所必需的修饰。几丁质激活后,CERK1招募CERK1相互作用蛋白磷酸酶1(CIPP1),一种预测的丝氨酸/苏氨酸磷酸酶,去磷酸化Tyr428并抑制CERK1信号传导。CIPP1随后从Tyr428去磷酸化的CERK1中分离出来,使CERK1重新获得Tyr428的自磷酸化并恢复到备用状态。这项工作揭示了植物几丁质信号传导途径,并表明受体激酶和磷酸酶可以通过磷酸化循环协调调节受体激酶的信号转导。
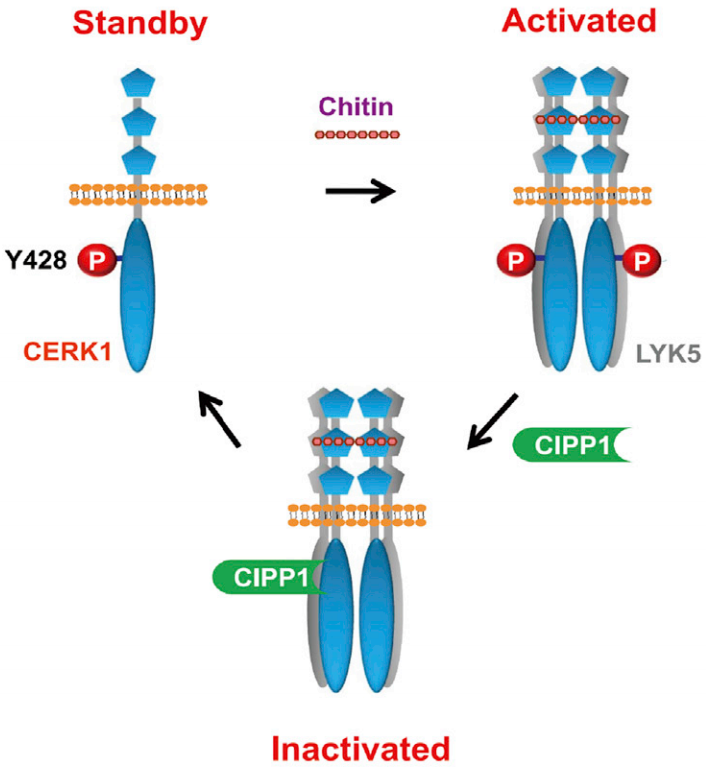
图7 CERK1和CIPP1调控的几丁质信号传导模型(Liu et al., 2018)。
磷酸化在植物生长发育中的作用
磷酸化修饰在植物生长发育中具有重要作用,参与了胞间信号交流和“植物-环境”相互作用等多个过程,对各个“激酶/磷酸酶-底物-表型”关系的明确和相关机制的深入了解,有助于人们从分子水平上认识生命过程。近年来发展的结构生物学、化学遗传学和磷酸化组学等技术为蛋白磷酸化的深入研究提供了更全面的手段。下面要给大家介绍的就有关于磷酸化组学方面的,具体如下:
磷酸化与BR信号路
油菜素内酯(BRs)是一种调节细胞分裂和应激反应的植物类固醇激素。BRs参与了许多重要的生物学过程,包括细胞伸长和分裂、光形态形成、繁殖以及生物和非生物胁迫反应。拟南芥的BR信号通路高度依赖于蛋白磷酸化水平、蛋白水平调控和下游转录调控。因此,在“Integrated omics networks reveal the temporal signaling events of brassinosteroid response in Arabidopsis”一文中,作者通过对不同BL(最活跃的BR)处理时间的拟南芥幼苗进行大规模转录组和磷酸化蛋白质组分析,确定了拟南芥对BR信号的动态响应。
作者分析了BL处理6个不同时间长的拟南芥幼苗的32,549个转录本,9,035个蛋白质组和26,950个磷酸化位点的水平。然后,作者构建了一个称为组学网络时空聚类和组学推理(SC-ION)的网络推理管道,该管道能够将这些多组学数据集成到一个内聚的调控网络中。作者的网络说明了BR反应的信号级联,从激酶底物磷酸化开始,以转录调节结束。作者使用网络预测来确定TF BRI1-EMS抑制因子1(BES1)上假定的相关磷酸化位点;另外还通过实验验证了它的重要性。此外,作者还发现了一种未表征的TF,作者将其命名为BRON-TOSAURUS(BRON),它调节细胞分裂。此外,作者发现born突变根对BL敏感。总之,这项工作展示了应用于多组学数据的综合网络分析的力量,并为BR响应过程中发生的分子信号事件提供了基本的见解。
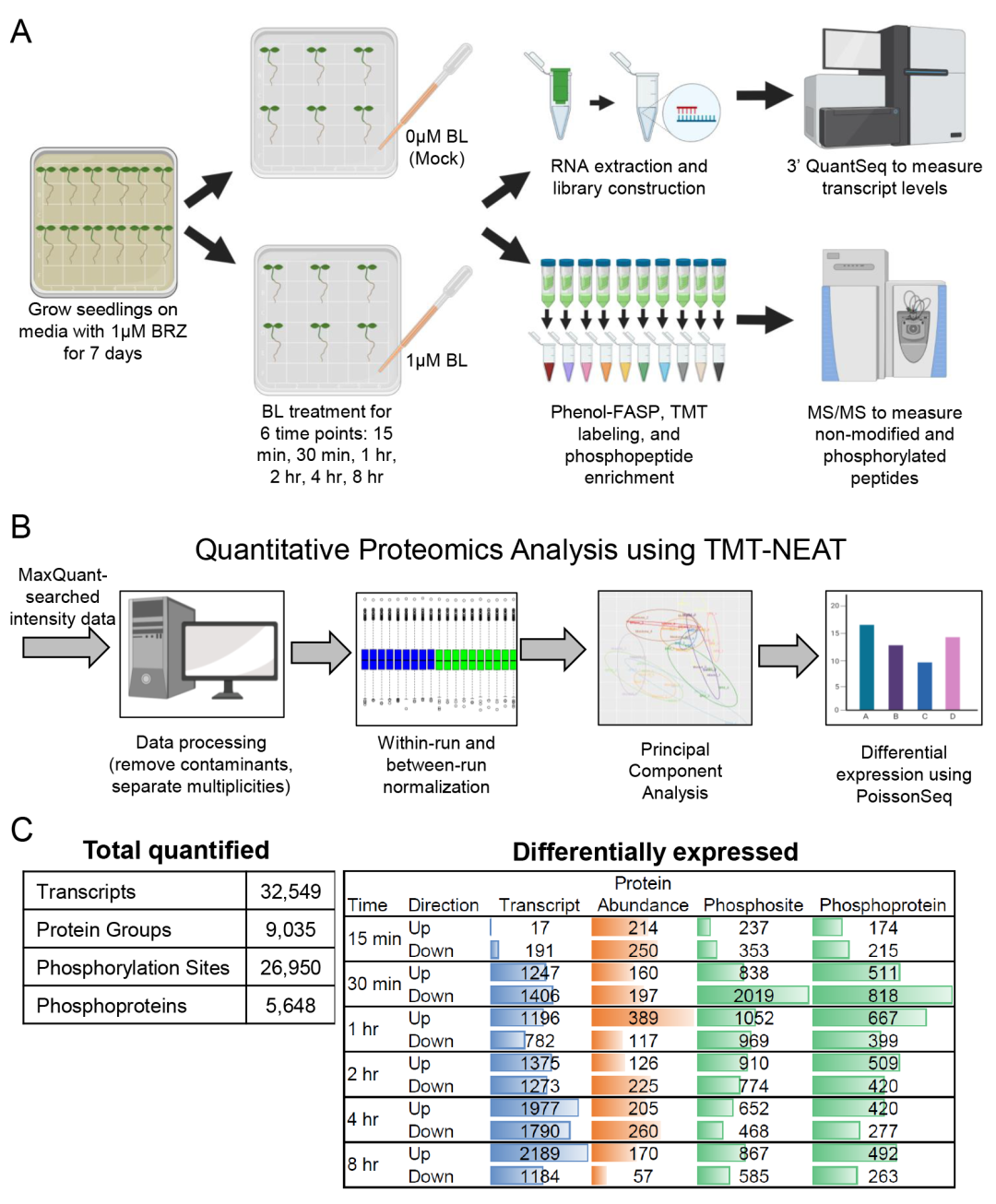
图8 BR响应的综合组学时间过程(Clark et al., 2021)。(A)收集分别在6个时间点(15min,30min,1h,2h,4h,8h)使用Mock和BL处理的幼苗作为样品。(B)TMT-NEAT定量蛋白质组学分析管道。(C)(左)转录本、蛋白质和磷酸化/磷酸化蛋白在每个时间点定量的总数。(右)每个时间点DE转录物、蛋白质和磷酸化位点/磷酸化蛋白的数量。彩色条形图表示每种数据类型中DE基因产物的相对数量。
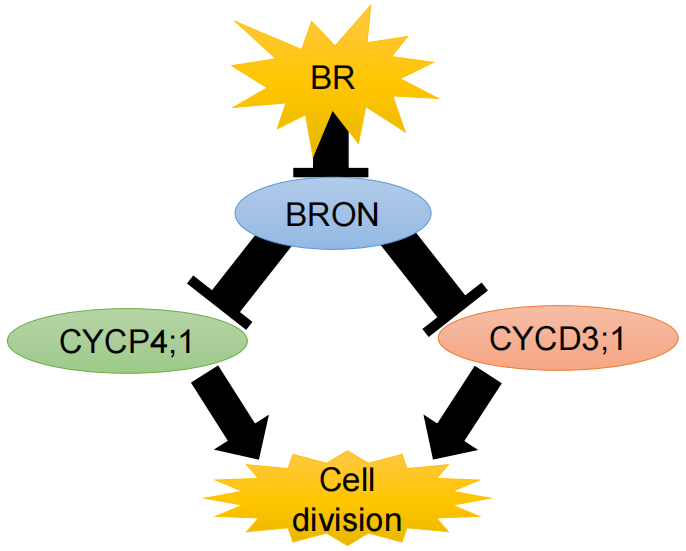
图9 BRON在BR反应中的作用模型(Clark et al., 2021)。BR抑制BRON,BRON抑制细胞周期蛋白CYCD3;1和CYCP4;1。这导致了BR诱导的细胞分裂。
磷酸化与开花
在小远之前写的一篇文章“一篇让你在信号通路网络学习上迅速进阶的Nature!”中详细解读了2022年8月发表在Nature上的一篇题为“Glucose-driven TOR-FIE-PRC2 signalling controls plant development”的研究文章。文章讲述了作者发现葡萄糖可以激活TOR激酶的活性,从而影响全基因组H3K27me3的水平,并且建立了TOR激酶和PRC2蛋白复合体之间的联系。此项研究为葡萄糖调控开花机理提供理论支持,有助于理解多细胞生物传递营养信息以重塑染色质状态和调控生长发育的功能。虽然重点是讲葡萄糖,但是磷酸化调控也必不可少,大家感兴趣的话可以自己看一下噢!

蛋白磷酸化是一种十分普遍的调控机制,几乎参与了每个生命活动过程和整个生命周期。通过小远给大家的介绍也可以证明确实如此,在本期的文章中,小远主要给大家介绍了磷酸化在植物应对非生物胁迫、生物胁迫以及生长发育过程中的作用,每一个类别小远都给大家展示了两篇文献案例,由于篇幅的原因,很多东西并没有具体展开,其实相关的文章还有很多,小远只能抛砖引玉,更多精彩的内容还需要大家自己去发现噢。后续关于磷酸化方面,如果小远有好的思路还会继续为大家分享,大家感兴趣的话可以持续关注我们噢!
