
我们在阅读文献的过程中常常会看到E3泛素连接酶,26S蛋白酶体等词汇,与它们同时出现的还有蛋白降解这一词汇,最开始的时候伯小远也是似懂非懂,感觉明白了又好像没有明白,后来发现这背后竟“隐藏”了这么多“秘密”!那么今天就和伯小远一起去探索吧!
伯小远查阅资料之后,发现以上词汇表示的其实就是泛素调节的蛋白降解途径!说到这里就不得不给大家介绍一些背景知识啦!


1 蛋白质翻译后修饰

基因水平的研究一般相对简单,但是一旦上升到蛋白水平,其难度就会大幅增加,这与蛋白存在各式各样的翻译后修饰有关。蛋白质翻译后修饰是蛋白质在翻译中或翻译后经历的一个共价加工过程,即通过一个或几个氨基酸残基加上修饰基团或通过蛋白质水解剪去基团而改变蛋白质的性质。磷酸化、泛素化、乙酰化、糖基化等都属于蛋白质翻译后修饰,通过上面的介绍,大家应该会发现今天伯小远要给大家介绍的就是其中的泛素化修饰。
2 泛素化

2.1泛素与泛素链

泛素(Ubiquitin,Ub)是一种由76个氨基酸组成的小分子蛋白质,分子量约8.5kDa,在进化过程中高度保守,全长包含7个赖氨酸(Lys)位点(K6,K11,K27,K33,K48和K63)、一个位于N端的甲硫氨酸(Met)位点(M1)以及一个位于C端的甘氨酸(Gly)位点(G76)。泛素分子之间通过这些位点进行结合形成泛素链,如果泛素都以同一种方式进行连接即为同型泛素链(Homotypic ubiquitin chains),反之,为异型泛素链(Heterotypic ubiquitin chains)。泛素链可以是直链,也可以形成分支结构。另外,泛素本身也可以发生多种修饰。
为了帮助大家理解,给大家列举一个直观的例子,如下图所示,左边是泛素分子的结构,中间和右边的两种结构分别表示分支结构的异型泛素链和直链异型泛素链,从图中可以观察到每个泛素分子的连接方式并不完全相同,所以是异型泛素链哦!
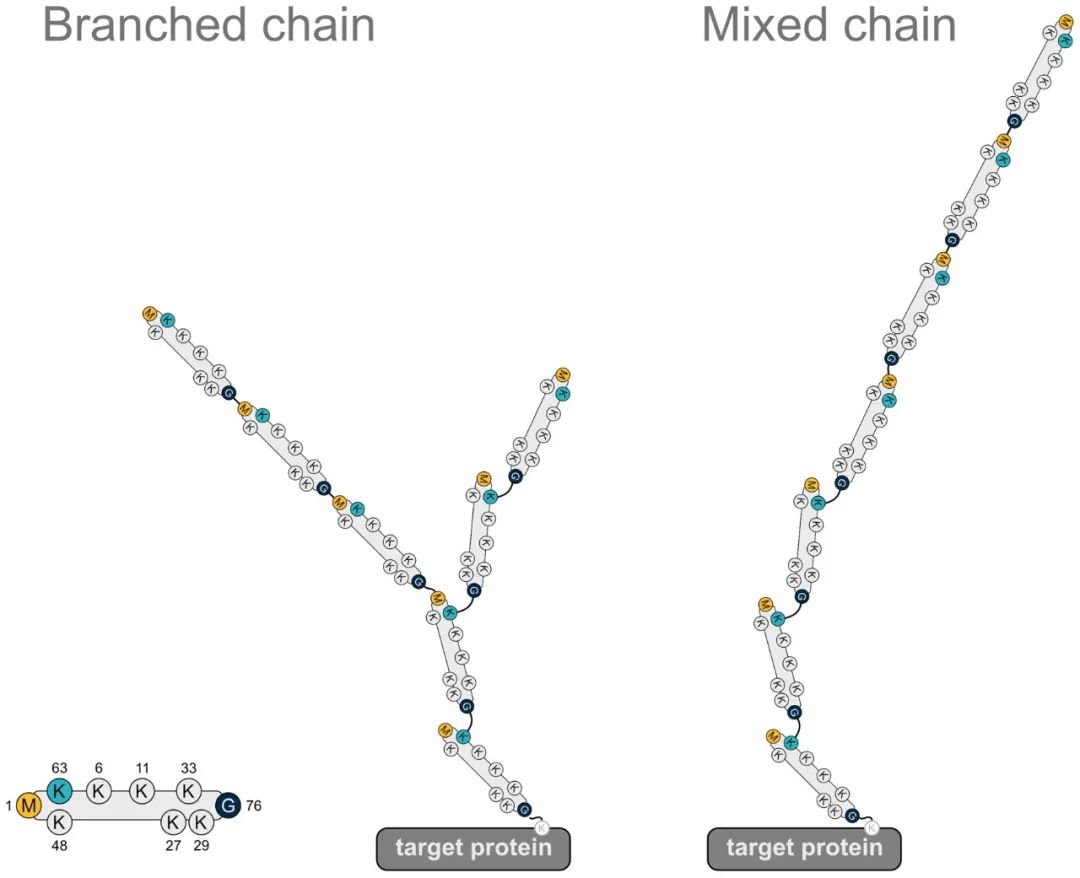
图1 含有M1链的异型泛素链(Gunnar Dittmar and Konstanze F. Winklhofer, 2020)。
注:最左边为泛素分子,中间是具有分支结构的异型泛素链,右边是直链异型泛素链。
2.2泛素化

泛素化是指泛素在一系列酶的催化作用下共价结合到靶蛋白上的过程。这里的一系列酶指的是泛素化级联反应过程中相互协同的3种酶:E1泛素激活酶(Ubiquitin-activating enzyme)、E2泛素偶联酶 (Ubiquitin-conjugating enzymes)和E3泛素连接酶(Ubiquitin-ligase enzymes)。
泛素连接酶E3主要有两大类:HECT结构域家族和RING结构域家族,最近又发现了一类新的E3家族:U.box蛋白家族。HECT结构域主要是通过与泛素形成催化作用所必需的硫酯键发挥作用,而RING结构域为E2和底物提供居留位点从而使E2催化泛素转移到底物上。
泛素化途径的具体过程如下图所示。首先,E1利用ATP提供的能量活化泛素分子生成Ub-E1复合体。Ub-E1复合体通过转酯作用将Ub转移到E2上形成Ub-E2复合体。Ub-E2复合体将Ub转移到靶蛋白有两种途径,第一种是通过E3特异性识别靶蛋白后直接将Ub的C端连接到靶蛋白Lys残基ε-氨基上;第二种是先将Ub通过转酯作用转移到E3上,再由E3特异性识别靶蛋白后将Ub的C端连接到靶蛋白Lys残基ε-氨基上(Stone, Sophia L., 2019)。简而言之,也就是在E1、E2、E3三类酶的依次催化下,泛素被以特异性的方式连接到靶标蛋白质上或靶标蛋白质上已经连接的泛素链上,其中E3泛素化连接酶决定靶蛋白的特异性识别。除此之外泛素化修饰还可以发生在蛋白质N端和一些其他氨基酸(半胱氨酸,丝氨酸,苏氨酸)上(Gunnar Dittmar and Konstanze F. Winklhofer., 2020;McClellan et al., 2019)。

图2 泛素化过程(Stone, Sophia L., 2019)。E1:E1泛素激活酶;E2:E2泛素偶联酶;E3:E3泛素连接酶;Target:靶蛋白;Ubiquitin:泛素;DUBs:去泛素化酶。
单个泛素分子以其C-末端赖氨酸与靶蛋白的一个Lys侧链相连叫做单泛素化,与多个赖氨酸残基相连叫做多泛素化。如果靶蛋白的单个Lys残基被多个泛素分子标记则称为多聚泛素化。
2.3去泛素化

泛素化是一个被严格调控的可逆过程,去泛素化酶(Deubiquitinating enzymes,DUBs)可以通过水解泛素分子之间或泛素与底物蛋白之间的肽键或异肽键,来逆转泛素化修饰(Fennell et al., 2018)。去泛素化酶对泛素化过程不仅起着抑制作用,而且可以通过分解泛素化抑制因子、再循环泛素分子、校对泛素化进程等方式促进泛素化过程,从而与泛素化系统共同组成一个复杂的调控网络(Sowa et al., 2009)。
2.4与泛素单链类型有关的生理作用

根据泛素与底物的连接位点,目前有9种方式的泛素化,包括M1,K6,K11,K27,K29,K33,K48,K63,G76。不同方式的泛素化调控不同的功能。其中,与蛋白酶体降解相关的泛素化为K48。K48连接是所有泛素链中最为常见的,约占所有连接的50%。K6泛素链可能与DNA损伤、线粒体自噬等相关。K11与K48结合形成的Lys48/Lys11支链可以加强蛋白酶体的降解,另外K11泛素链还可以调控细胞周期。K27连接的泛素链可以作为DNA损伤反应(DDR)中蛋白质招募的支架。K29则可以调控溶酶体的降解。K33链在的各种生物过程中都有涉及。K63连接的泛素链修饰和单泛素化修饰可能参与DNA修复和细胞内吞作用。MET1连接的线性泛素链可以作为NF-κB信号的关键正向调节因子,在肿瘤、炎症和免疫等方面发挥重要作用(图3A)。
泛素化通过对蛋白质稳定性、亚细胞定位、活性以及相互作用等方面进行调控,广泛参与了诸如免疫反应调控、线粒体自噬、DNA损伤修复、细胞周期调控、表观遗传调控、细胞凋亡和蛋白质降解等生理过程(图3A)。
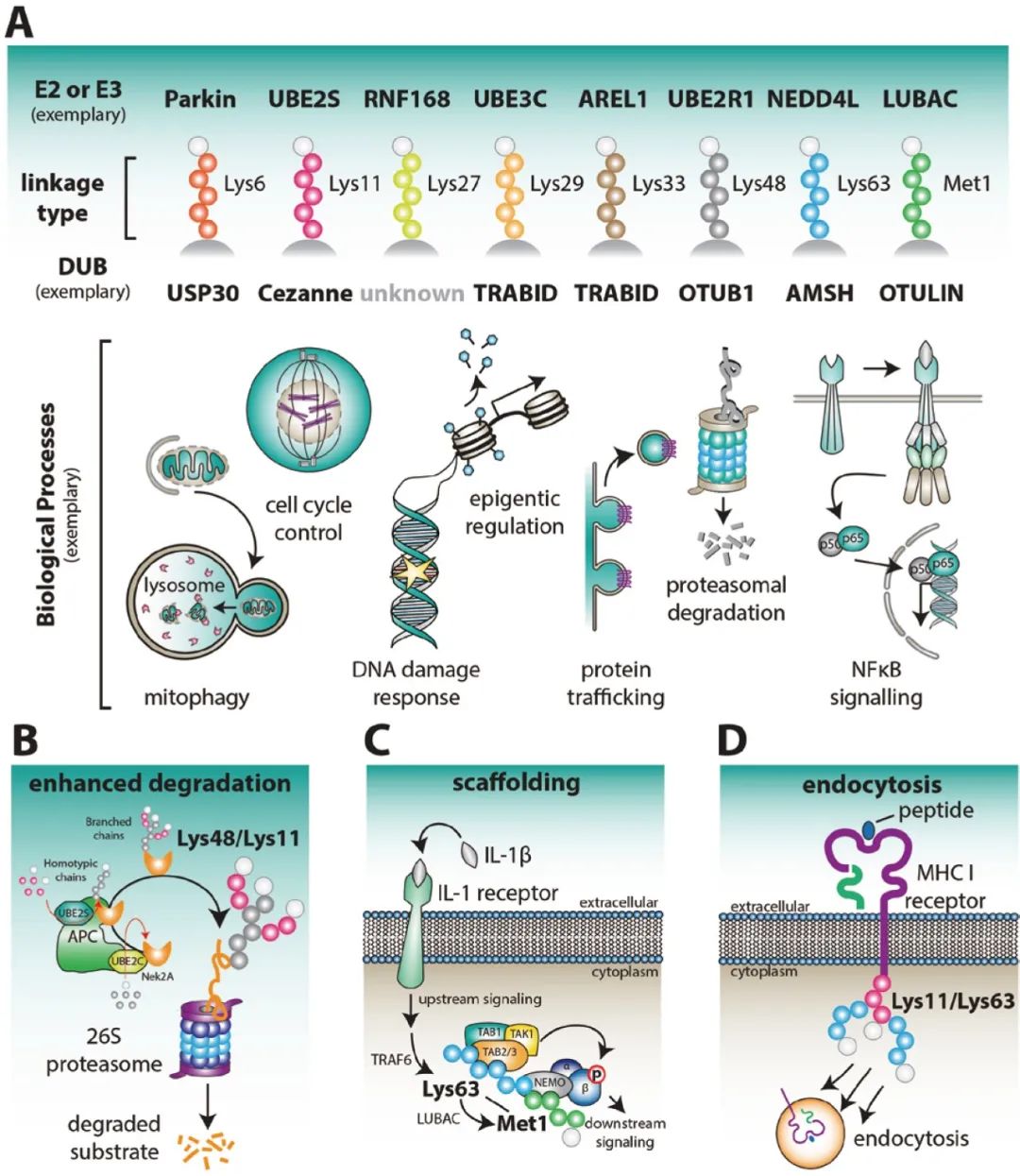
图3 与泛素单链类型有关的生理作用(Kirby N Swatek and David Komander, 2016)。(A)不同类型的泛素链以及参与的一些典型的生理过程。(B)APC/C在有丝分裂早期活跃,并通过Lys48/Lys11-linked多聚泛素修饰细胞周期调控因子,如Nek2A。在这个过程中,UBE2C首先在底物上组装短链,然后通过Lys11连接的聚合物在每个泛素上延长这些短链。Lys48/Lys11支链增强了蛋白酶体的降解。(C)混合或分支的Lys63/ Met1链可作为免疫受体(如IL-1受体)的蛋白质支架,促进NF-κB信号传导。(D)病毒E3连接酶通过连接混合或分支的Lys11/Lys63连接的泛素链来启动MHC I类受体的内吞内化。
3 泛素-蛋白酶体系统


通过上面的介绍,泛素化涉及的生理功能有很多,伯小远就挑其中比较典型的泛素介导的蛋白降解为大家细讲吧!毕竟细胞内80%~90%的蛋白都是通过泛素途径降解的(Pickart, Cecile M. and David Fushman, 2004)。泛素控制的蛋白降解过程主要是,需要被降解的蛋白首先被泛素标记(通过上面的介绍可以知道主要是被K48泛素链标记,有研究表明一般是被4条K48泛素链标记才能被蛋白酶体识别,后面有新的研究更新了这一说法,但具体情况伯小远这里就不细讲了,大家有兴趣可以自己去查阅文献哦!),然后蛋白酶体(主要是26S蛋白酶体)特异性地识别这个带有泛素标签的底物蛋白,进而将其降解。该降解系统被称为泛素-蛋白酶体系统(Ubiquitin-proteasome system, UPS)。泛素控制的蛋白质降解具有重要的生理意义,它不仅能清除错误的蛋白质,对细胞生长周期、DNA复制以及染色体结构也都有重要的调控作用。
3.1蛋白酶体与26S蛋白酶体

蛋白酶体的大小约为20S,呈桶状结构,能够将几乎所有的蛋白降解成7~9个氨基酸长度的肽链。蛋白酶体降解蛋白质的活性中心位于桶状结构的中心,与细胞中其它部分隔离。进入活性部位的唯一通路是“锁”(一种19S的复合物),它能够识别被泛素化的蛋白质,解除其折叠结构,并辅助蛋白质穿过酶体的狭窄通道,进入位于桶状结构中心的活性位点。蛋白质被降解成7~9个氨基酸长度的短肽后,从蛋白酶体的另一端被释放。此外,19S复合物上还含有一种异肽酶,能够将泛素从底物蛋白质上去除,去除的泛素可以循环利用。
26S蛋白酶体系统由20S蛋白酶体和19S蛋白酶体两个亚复合物组成,是蛋白酶体的一种。
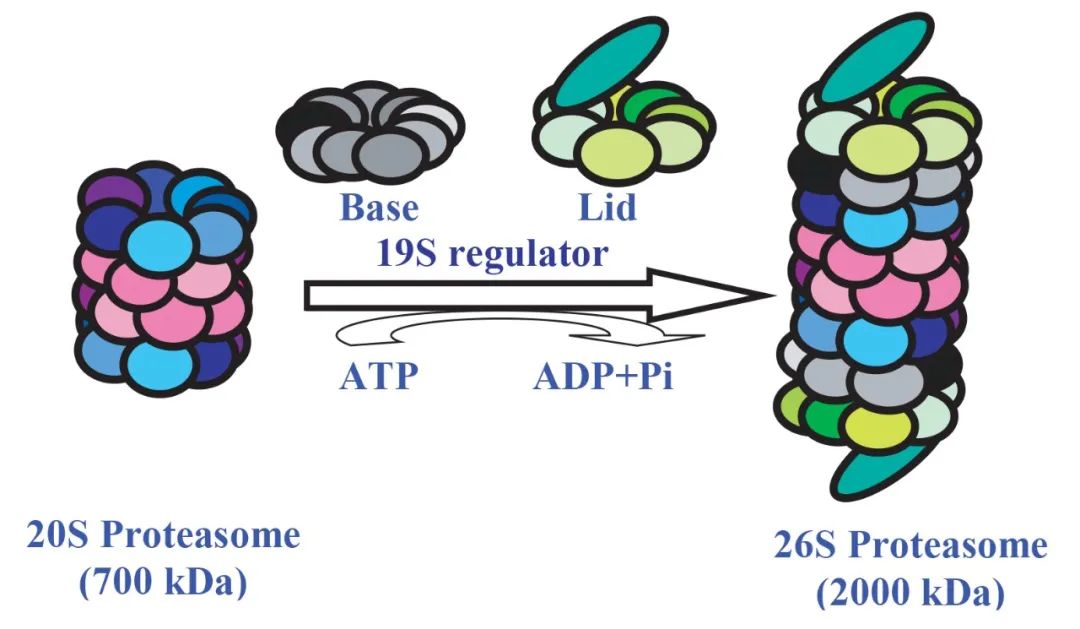
图4 26S蛋白酶体的形成,该过程需要消耗ATP(Nandi et al., 2006)。

早在1942年,科学家们就发现了蛋白质分子的降解现象,但是早期的探索方向出现了偏差,到了20世纪70年代到80年代间,Aaron Ciechanover和Avram Hershko在Irwin Rose主持的福克斯•蔡斯癌症中心做访问学者。在此期间,他们联合发表了一系列论文,揭示了泛素介导的蛋白质降解机理,从而指明了蛋白质降解研究的方向。其中1979年在PNAS上发表的论文被诺贝尔化学奖评选委员会称为“突破性成果”,并奠定了他们获得诺贝尔奖的基础。

图5 以色列科学家Aaron Ciechanover、Avram Hershko和美国科学家Irwin Rose因发现泛素调节的蛋白质降解被授予2004年诺贝尔化学奖。
任何一个领域的突破都需要科学家们不懈地努力,我们作为站在巨人肩膀上的后辈,除了向他们致敬之外,更重要的是在此基础上继续做更有意义的科研哦!正如你们此刻正在做的研究!
上面关于泛素化以及泛素-蛋白酶体系统,小远基本都介绍了一遍,以上内容对于大家入门基本已经够了,为了让大家理解的更深刻,下面伯小远将结合一篇文献,给大家讲讲关于泛素化具体应该如何研究?这里需要说明一下,小远列举的例子只不过是泛素化研究里面的冰山一角,因为这方面的研究实在是太多了,所以今天就先给大家尝尝鲜,后期小远将为大家系统整理关于泛素化的一些研究方法,大家一起期待吧!
4
文献举例

2019年发表在Molecular plant上的一篇题为“Two RING-Finger Ubiquitin E3 Ligases Regulate the Degradation of SPX4, An Internal Phosphate Sensor, for Phosphate Homeostasis and Signaling in Rice”的文章,是一篇比较好的关于泛素化研究的代表,这里重点讲解里面关于泛素化的相关研究,其它的部分暂时先不讲!
4.1背景知识

在真核生物中,含有SPX结构域的蛋白质(SPXs)在无机磷酸盐(Pi)的感知、信号传递和转运中起着重要的作用。在植物中,SPX可以整合细胞的Pi状态,并负调控磷饥饿应答蛋白(PHRs)的活性。在Pi缺乏条件下,SPXs(例如SPX4)的稳定性降低。其中,磷酸饥饿应答蛋白(PHRs)是植物Pi信号传递的中枢调节因子,SPX蛋白可以抑制PHRs的转录活性。
SPX4的稳定性对Pi信号具有重要的意义。然而,负调节剂SPX4的降解机理尚不清楚。因此,作者以水稻为研究对象,研究了SPX4的降解机制,从而解析了相关的Pi信号通路。
4.2实验方法与结果

4.2.1筛选靶向SPX4的E3连接酶并验证互作
作者首先假设E3泛素连接酶可以特异性地识别SPXs,并调节它们在植物中的降解。为了筛选靶向SPX4的E3连接酶,作者以SPX4为诱饵筛选水稻根源cDNA文库,得到了含锌指结构域和环指结构域的E3连接酶SDEL1及其同源物SDEL2。为了验证筛库的结果,作者又分别用酵母双杂、BiFC、Co-IP这3种方法进行了点对点的验证,结果表明E3连接酶SDEL1和SDEL2在体外和体内与SPX4均存在相互作用(图6)。
4.2.2证明SDEL1与SDEL2具有E3泛素酶活性
由于SDEL1和SDEL2含有典型的E3连接酶结构域,因此作者假设SDEL1和SDEL2具有E3连接酶活性。
证明方法:
作者在大肠杆菌中表达和纯化了His标记的SDEL1和SDEL2(但只有His标记的SDEL1(SDEL1-His)被成功表达和纯化)。接着进一步使用商业化的人E1(E1-his, His-tagged)和E2(UbcH5a-His)以及His标记的SDEL1融合蛋白进行体外泛素化检测。
结果:
E2蛋白在E1的存在下被泛素化(图6E,第1泳道)。在反应中加入SDEL1,利用抗生物素抗体(泛素与生物素交联)检测到一个梯状蛋白。
结论:
SDEL1具有E3 Ub连接酶活性。SDEL1的E3 Ub连接酶活性依赖于E1和E2的存在,并随着SDEL1蛋白水平的升高而增强(图6E,2-5泳道)。
4.2.3证明SPX4是否是SDEL1的泛素化底物
证明方法:
将GST-SPX4与E1、E2、SDEL1设置实验组与对照组进行孵育。
结果:
将标记有谷胱甘肽S-转移酶(GST)的SPX4与E1、E2和SDEL1一起孵育,可以检测到强烈的蛋白阶梯信号(图6F,第5泳道),而单独与E1和E2孵育并不能使泛素添加到SPX4中(图6F,第4泳道)。
结论:
SDEL1介导了SPX 4的泛素化。
通过上面3个部分,得出结论:SDEL1和SDEL2在体外和体内均能与SPX4发生相互作用,SDEL1是一种能在体外泛素化SPX4的功能性E3 Ub连接酶。
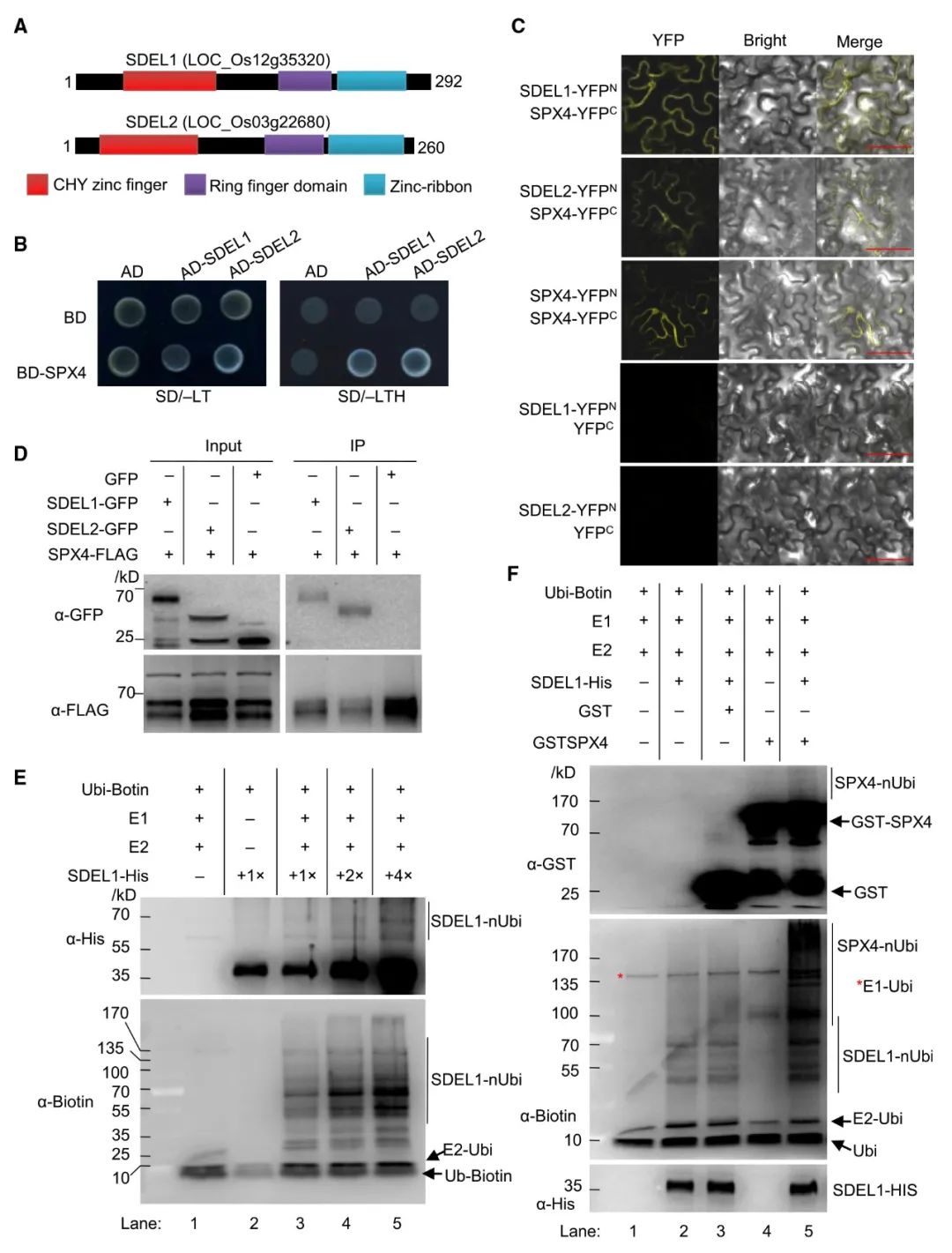
图6 SDEL1显示E3泛素连接酶活性并泛素化SPX4(Ruan et al., 2019)。(A)SDEL1和SDEL2预测蛋白结构域示意图。(B)Y2H法检测SDEL1/2与SPX4的相互作用。(C)SDEL1/2与SPX4相互作用的BiFC分析。(D)SDEL1/2和SPX4在体内相互作用的Co-IP实验。(E)在存在或不存在E1和E2的情况下,使用不同剂量His标记的SDEL1检测E3 Ub连接酶的活性。使用抗His抗体检测SDEL1和泛素化SDEL1蛋白(上图)。用抗生物素抗体检测泛素化蛋白(下图的底部)(泛素与生物素交联)。(F)SDEL1能够泛素化SPX4。采用抗GST和抗生物素抗体检测泛素化SPX4蛋白。
4.2.4 SDEL1和SDEL2在体内泛素化和降解SPX4
鉴于SDEL1和SDEL2在体外与SPX4相互作用并泛素化,假设SPX4在体内的泛素化和降解依赖于SDEL1和SDEL2。
证明方法:
为了验证这一假设,作者利用SDEL1和SDEL2功能缺失突变体和过表达株系进行实验。其中功能缺失突变体利用CRISPR/Cas9得到,并杂交得到双突变体sdel1-1/sdel2-1。对Pi缺乏条件下生长的植物总蛋白提取物中的重组GST-SPX4蛋白进行游离降解分析。
结果:
Western blot结果显示,GST-SPX4与野生型(WT)或sdel2-1突变体的总蛋白提取物共孵育,其半衰期约为6分钟。然而,当与sdel1-1突变体的提取物孵育时,GST-SPX4的降解半衰期明显长于WT提取物。当与sdel1-1/sdel2-1双突变体的提取液一起孵育时,降解半衰期几乎是与WT提取液孵育的GST-SPX4的2.5倍。与WT和突变体提取物相比,与SDEL1或SDEL2过表达株系的提取物孵育显著缩短了GST-SPX4的降解半衰期(图7A,B)。
结论:
这些结果表明,SDEL1和SDEL2都正向调节SPX4的降解。
由于SDEL1和SDEL2可以泛素化SPX4并调控其降解,作者假设植物中SPX4的蛋白水平受到SDEL1和SDEL2的影响。
证明方法:
为了验证这一点,作者利用35S-SPX4-FLAG(以下简称SPX4-FLAG)转基因水稻植株进行实验。与之前的报道一致,在SPX4过表达系中,SPX4-FLAG植株显示出较低的Pi含量,表明SPX4-FLAG融合蛋白在体内具有功能。选择一个稳定的SPX4-FLAG(SPX4-FLAG-5)转基因株系,利用CRISPR/Cas9开发sdel1/sdel2双突变体,以及过表达SDEL1-和SDEL2的株系(SDEL1-OE和SDEL2-OE)。通过抗FLAG抗体Western blot进一步分析WT、sdel1/sdel2、SDEL1-OE和SDEL2-OE基因背景下的SPX4-FLAG蛋白水平。
结果:
该分析表明,在+P和-P条件下,sdel1/sdel2双突变体的SPX4蛋白水平明显高于WT(图7C)。相比之下,在SDEL1-OE和SDEL2-OE过表达系中,在Pi充足的条件下,SPX4蛋白水平远低于WT(图7C)。
结论:
这些结果表明,SDEL1和SDEL2通过介导SPX4蛋白的降解来调节其丰度。
又因为SDEL1在体外泛素化的SPX4在-P条件下显著降解,作者推测在-P条件下SPX4在sdel1-del2中泛素化程度降低,而在SDEL1-和SDEL2过表达株系中泛素化程度增加。
证明方法:
为了验证这一假设,作者在-P条件下培养14日龄的SPX4-FLAG/WT、SPX4-FLAG/sdel1sdel2、SPX4-FLAG/SDEL1-OE和SPX4-FLAG/SDEL2-OE幼苗7天。然后将植株转入添加了20μM MG132(一种蛋白酶体抑制剂,可以阻断泛素化蛋白的降解)的-P溶液中,再培养2天,最后收获提取蛋白质。将泛素化和非泛素化的SPX4蛋白用抗FLAG磁珠免疫沉淀。并用抗FLAG抗体和抗Ubi抗体分别免疫印迹法检测SPX4和泛素化SPX4。
结果:
在MG132存在的情况下,WT、sdel1/sdel2和SDEL过表达系之间SPX4蛋白水平无明显差异(图7D)。然而,在sdel1/sdel2双突变体中多泛素化的SPX4水平明显低于WT,而在SDEL1-和SDEL2过表达株系中多泛素化的SPX4水平高于其他遗传背景(图7D)。
结论:
说明SDEL1和SDEL2在植物中对SPX4泛素化至关重要。
以上3个部分的结果共同表明,Pi缺失诱导的SPX4降解依赖于SDEL1和SDEL2。
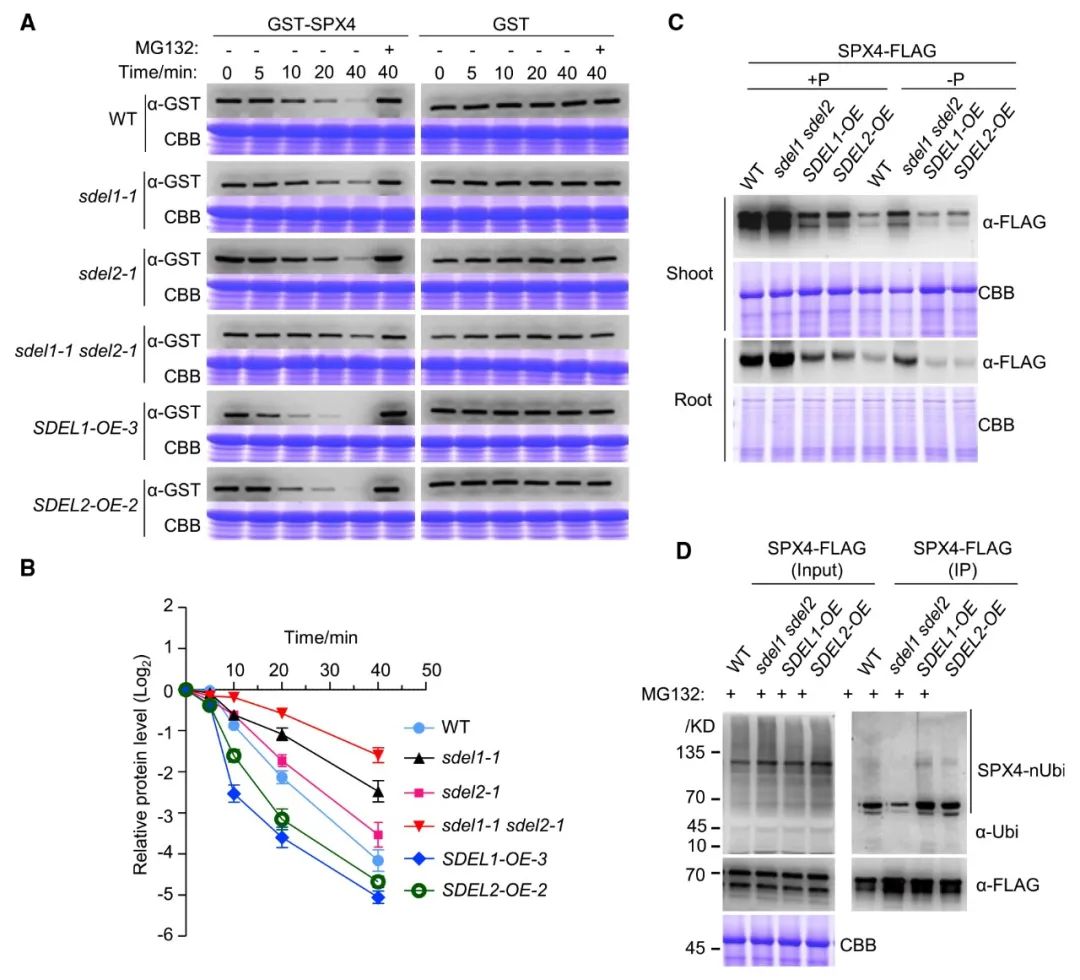
图7 SDEL1和SDEL2对于SPX4的降解至关重要(Ruan et al., 2019)。(A)SPX4在野生型(WT)、sdel1-1、sdel2-1、sdel1-1、SDEL1-OE-3和SDEL2-OE-2中的细胞游离降解实验。GST-SPX4融合蛋白在大肠杆菌中表达并纯化。分别用在-P条件下水培7天的WT、sdel1-1、sdel2-1、sdel1-1、sdel1-1、SDEL1-OE-3和SDEL2-OE-2水稻叶片蛋白提取物(总蛋白20mg)中的100ng蛋白在28℃下孵育不同时间。反应在没有(-)或(+)40μM MG132的情况下进行。采用抗GST抗体,Western blotting检测GST-SPX4和GST蛋白。(B)计算GST-SPX4在不同植物提取物中孵育后的相对残留量,并绘制在对数图上。GST-SPX4蛋白水平归一化至GST对照。(C)WT,sdel1sdel2,以及SDEL1和SDEL2过表达系中的SPX4水平。用抗FLAG抗体免疫印迹法检测+P和-P条件下21日龄植株(SPX4-FLAG、sdel1sdel2/SPX4-FLAG、SDEL1-OE/SPX4-FLAG、SDEL2-OE/SPX4-FLAG)的地上部(上)和根(下)蛋白。等量的蛋白质(100μg)用于免疫印迹。考马斯亮蓝(CBB)染色显示蛋白质含量相似。(D)SPX4的泛素化主要依赖于SDELs。将14日龄的SPX4-FLAG、sdel1sdel2/SPX4-FLAG、SDEL1-OE/SPX4-FLAG和SDEL2-OE/SPX4-FLAG植株转入-P溶液中培养7天;再将20μM MG132加入-P溶液中培养2天。蛋白提取物(Input)用抗FLAG磁珠免疫沉淀(IP)。用抗FLAG抗体检测SPX4,用抗Ub抗体检测泛素化蛋白。考马斯亮蓝(CBB)染色表明,蛋白质含量相近。

篇幅有限,后面的部分伯小远在这里就不再介绍了,其实后面还有很多实验用到的方法都很经典,大家有兴趣可以自己先去研究研究。关于泛素化研究举例今天就先介绍这么多,大家先消化消化,后期我们再来进行更深入的了解。到了这里,大家还记得文章一开始提到的E3泛素连接酶、26S蛋白酶体、以及蛋白降解吗?在举例的这篇文章里都有,只是整体的实验过程没有给大家讲完,但是蛋白降解这一部分基本都讲了,如果之前不懂,现在再去看是不是就懂了呢!为了让大家看的更直观,将本篇得到的信号通路图展示给大家:
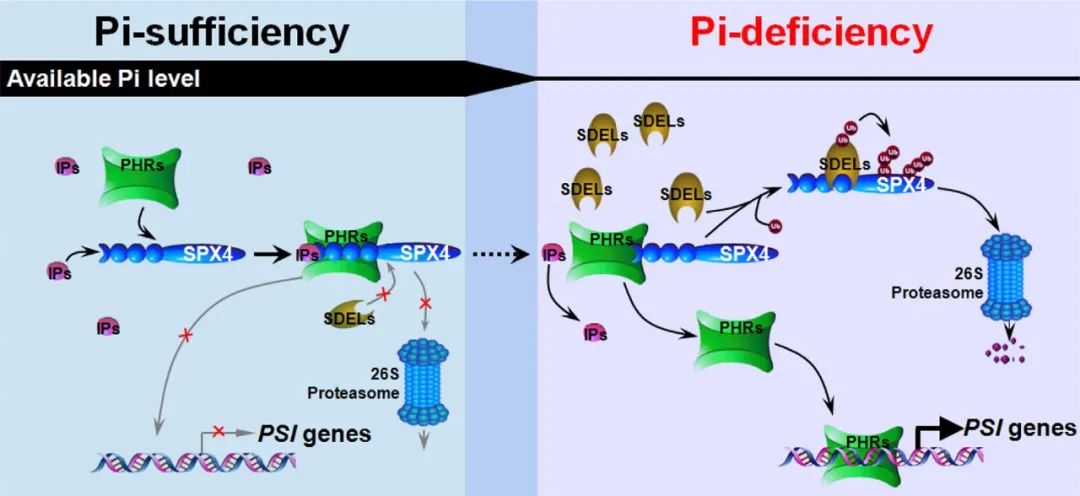
图8 SDEL-PHR-SPX模块调节Pi饥饿反应的工作模型(Ruan et al., 2019)。该模型说明了Pi信号调节器SDELs、SPX4和PHRs如何共同调控Pi饥饿反应。在Pi充足条件下,SPX4-IPS-PHRs复合物的形成阻止了SPX4被SDELs降解,并抑制了下游PSI基因的激活。而在Pi缺乏的情况下,SDELs的积累促进了SPX4的降解,而由于IPs的减少,SPX4与PHRs分离。因此,PHRs可以激活下游PSI基因。红色叉表示对调控过程的抑制。IPs,肌醇焦磷酸盐;Ub,泛素;PSI,磷酸盐饥饿诱导。

小远叨叨
最后我们一起回顾一下上面的文章,首先,本文介绍了关于泛素化的一些背景知识,然后在背景知识的基础之上,结合文献给大家讲了如何证明一个蛋白具有E3泛素化连接酶活性、以及如何在体外和体内验证泛素化,概括起来内容似乎很少,但是完全弄明白讲的这些还是需要多下功夫哦!

