CRISPR基因编辑
CRISPR意为规律成簇间隔短回文重复序列,CRISPR/Cas是一种微生物获得性免疫系统。其作为基因编辑工具被开发后,迅速爆发出巨大的潜力,可以说是为生命科学和医学研究开启了新的篇章。其中最具代表性的是CRISPR/Cas9,CRISPR/Cas12a、CRISPR/Cas13a三种系统,其中又以CRISPR/Cas9的应用最为广泛。当然,此外CRISPR还有很多意想不到的用法,如Primeedit先导编辑、进行基因激活/干扰的CRISPRa/i系统、m5C甲基化/去甲基化系统、m6A甲基化/去甲基化系统等等。正如基因编辑领域领军人物之一张峰所说:约束CRISPR应用的,只有我们的想象力。
但CRISPR/Cas系统也存在着一些固有问题,例如脱靶效应、PAM(间隔序列)对靶点的限制、以及编辑活性等。如何让CRISPR系统变得精准可控,会是基因编辑领域往后的研究重点。
CRISPR系统的发现
CRISPR系统的最早发现者应该是日本微生物学家石野良纯(YoshizumiIshino),1987年,他在对大肠杆菌的碱性磷酸酶同工酶测序时,意外的发现非编码区存在一些异常重复序列。微生物不像某些高级动物那样财大气粗,对资源的利用必然是极致的高效,所以重复序列这种低效结构,对细菌来说那绝对是对资源的极大浪费。但重复序列既然出现了,意味着这些重复序列必定有着极其重要的作用!更奇怪的是,和常见的串联重复序列不同,微生物的这一重复却是“重复-间隔(spacer)-重复”的排列形式(如图1)。这种情况一经发现,就引起了石野良纯他们的兴趣,不过哪怕就算石野良纯意识到了这段序列的不同寻常,以当时的技术和知识条件来说,差不多也只能到此为止了[1]。
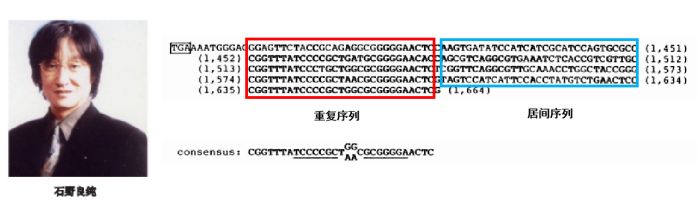 图1. CRISPR序列的发现[1]
图1. CRISPR序列的发现[1]
其后,西班牙科学家弗朗西斯科·莫西卡(Francisco Mojica)在地中海嗜盐古菌中也发现一现象[2]。并且后续的一系列研究中发现,至少40%的细菌和90%的古细菌中都有这种现象。2002年研究者们将这种特殊结构定义为成簇规律性间隔短回文重复序列(clustered regularly interspaced short palindromic repeat),即为CRISPR。此后荷兰科学家詹森还发现,重复序列的附近会伴随出现些编码基因,他意识到,这些编码基因的功能必然和CRISPR有关,便将这些基因命名为CRISPR相关基因(CRISPR-associated gene),即为Cas[3]。 2002年,又有研究发现,CIRPSR的序列虽不编码蛋白,但可以被转录。研究者们认识到了这套系统的复杂性,但这套复杂的系统,究竟是用来做什么的呢?
终于,在2005年,CRISPR系统迎来了一个重大发现,CRISPR的间区序列(Spacer)居然来自于病毒!该结果由西班牙和法国的三个不同的课题组独立发表,足以说明,这些病毒序列的存在绝不是意外。
这一发现,又激发了NCBI的进化生物学家库宁(Eugene Koonin) 的灵感,他提出了CIRPSR是细菌的获得性免疫系统假说,并将其和1998年发现的RNA干扰(RNAi)现象结合在一起,提出了CRISPR干扰假说。
这又给了法国科学家法鲁道夫·巴兰古(Rodolphe Barrangou)灵感,他任职的酸奶公司时长会发生噬菌体感染的情况,用于发酵的嗜热链球菌大量死亡[4]。 鲁道夫·巴兰古等人使用P1和P2噬菌体侵染嗜热链球菌,在侵染后存活下来的菌株CRISPR序列中,中果然发现了噬菌体的片段,并在一系列的实验中,成功的验证了库宁猜想。CRISPR正如高等动物的抗体系统,是细菌用于对付病毒的获得性免疫系统。
但事情发展到这里还并没有结束,库宁的猜想有那么一点点的错误,属于临门一脚撞在了球框上。后续的研究发现,CRISPR系统的作用原理并非RNA干扰,而是一种由CRISPR转录出来的crRNA(CRISPR RNA)介导的核酸酶,可以特异性的对噬菌体核酸进行切割,其特异性正来自于获取自噬菌体病毒的spacer序列。CRISPR的面纱到这里才终于得以揭开。
CRISPR系统
CRISPR系统共有三个型,为I、II、III型,三型又分为多个类和小类,其中I型和III型因为作用机制复杂,参与的蛋白过多,无法进行有效运用;II型最为简单,仅一个Cas蛋白参与反应,第一个被应用于基因编辑的Cas9系统就是II型系统,其后的编辑系统大多以II型作为基础开发。
CRISPR序列和Cas基因两个部分,Cas基因表达为各种Cas蛋白,这些蛋白有核酸酶、解旋酶、整合酶、聚合酶等一系列活性;CRISPR序列在leader的引导下转录为pre-crRNA,pre-crRNA再被加工成包含Spacer序列和Direct pepeat(重复序列)短RNA序列; 同时trarcrRNA(Trans-activating crRNA,反式激活crRNA)也被转录出来(仅部分系统具有tracrRNA),tracrRNA序列会和crRNA发生互补形成复合体[5]。
crRNA或crRNA-tracrRNA会和Cas蛋白形成复合体,复合体以crRNA上的spacer序列为引导,将和spacer序列互补的靶序列切割[5]。
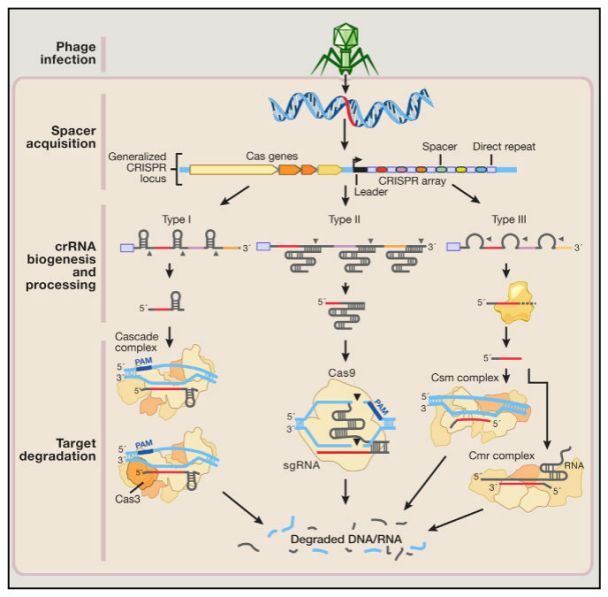 图2. 细菌CRISPR自然侵染系统[5]
图2. 细菌CRISPR自然侵染系统[5]
除此之外,绝大多数CRISPR系统的靶向性还有一定的限制,那就是PAM序列 (Protospacer Adjacent Motif,原间隔相邻序列),只有Cas酶与PAM结合后,其核酸酶活性才能开启。
参考文献:
[1] YOSHIZUMI ISHINO, HIDEO SHINAGAWA, KOZO MAKINO, Nucleotide Sequence of the iap Gene, Responsible for Alkaline Phosphatase Isozyme Conversion in Escherichia coli, and Identification of the Gene Product. JOURNAL OF BACTERIOLOGY, 1987, 5429-5433
[2] Long stretches of short tandem repeats are present in the largest replicons of the Archaea Haloferax mediterranei and Haloferax volcanii and could be involved in replicon partitioning
[3] Identification of genes that are associated with DNA repeats inprokaryotes
[4] CRISPR Provides Acquired Resistance Against Viruses inProkaryotes
[5] Hsu, P.D., E.S.Lander, and F. Zhang, Development and Applications of CRISPR-Cas9 for Genome Engineering.Cell, 2014.157(6): 1262-1278.

